Teoria da estrutura química dos compostos orgânicos. Classificação das substâncias orgânicas. Tudo sobre matéria orgânica
| Nome da classe de conexão | Fórmula geral |
| Alcanos | C n H 2 n +2 |
| Alcenos, cicloalcanos | C n H 2 n |
| Alcinos, alcadienos, cicloalcenos | C n H 2 n -2 |
| Álcoois monohídricos, éteres | C n H 2n+1 OH |
| Álcoois di-hídricos | C n H 2n (OH) 2 |
| álcoois tri-hídricos | C n H 2n-1 (OH) 3 |
| Aldeídos (limitantes), cetonas | C n H 2n+1 CHO |
| Ácidos carboxílicos monobásicos, ésteres | C n H 2n+1 COOH |
| Ácidos carboxílicos dibásicos | С n H 2n (COOH) 2 |
| Aminas | C n H 2n+1 NH 2 |
| Compostos nitro | C n H 2n+1 NO 2 |
| Aminoácidos | C n H 2n NH 2 COOH |
| Hidrocarbonetos aromáticos, homólogos de benzeno | C n H 2n-6 |
| aromático álcoois monohídricos | C n H 2n-7 OH |
| Álcoois di-hídricos aromáticos | C n H 2n-8 (OH) 2 |
| Aldeídos aromáticos | C n H 2n-7 CHO |
| Ácidos monobásicos aromáticos | C n H 2n-7 COOH |
Algoritmo de formulação de isômero de alcano
1. Determine o número de átomos de carbono da raiz do nome do hidrocarboneto.
2. Desenhe um diagrama de uma cadeia de carbono normal e numere os átomos de carbono nela.
3. Desenhe um diagrama da cadeia de carbono numerada dos isômeros, que são um átomo de carbono a menos que a cadeia normal, anexe esse átomo de carbono em todas as posições possíveis aos átomos de carbono da cadeia principal numerada, exceto nos extremos.
4. Desenhe um diagrama da cadeia de carbono numerada dos isômeros em que há dois átomos de carbono a menos em comparação com a cadeia normal; anexar esses dois átomos de carbono em todas as posições possíveis aos átomos de carbono da cadeia principal numerada, exceto os extremos.
5. Insira os átomos de hidrogênio, levando em consideração as unidades de valência ausentes para os átomos de carbono nos esquemas de cadeia de carbono (valência do carbono - IV).
6. O número de átomos de carbono e hidrogênio na cadeia de carbono dos isômeros não deve mudar.
Algoritmo para compilar fórmulas de hidrocarbonetos por seu nome
1. Determine o número de átomos de carbono na molécula pela raiz do nome do hidrocarboneto.
2. Desenhe uma cadeia de carbono de acordo com o número de átomos de carbono na molécula.
3. Numere a cadeia carbônica.
4. Estabeleça a presença da ligação carbônica correspondente na molécula pelo sufixo do nome do hidrocarboneto, descreva esta ligação na cadeia carbônica.
5. Substitua os radicais de acordo com o número de átomos de carbono na cadeia.
6. Desenhe traços para as valências que faltam nos átomos de carbono.
7. Preencha os átomos de hidrogênio ausentes.
8. Imagina Fórmula estrutural na forma abreviada.
Nomes de algumas substâncias orgânicas
| Fórmula química | Nome sistemático da substância | Nome trivial de uma substância |
| CH 2 Cl 2 | diclorometano | cloreto de metileno |
| CHCl 3 | Triclorometano | Clorofórmio |
| CCl 4 | Tetracloreto de carbono | tetracloreto de carbono |
| C 2 H 2 | Etina | Acetileno |
| C 6 H 4 (CH 3) 2 | Dimetilbenzeno | xileno |
| C 6 H 5 CH 3 | Metilbenzeno | Tolueno |
| C6H5NH2 | Aminobenzeno | Anilina |
| C6H5OH | Hidroxibenzeno | Fenol, ácido carbólico |
| C 6 H 2 CH 3 (NO 2) 3 | 2,4,6-trinitrotolueno | Tol, trotil |
| C 6 H 3 (OH) 3 | 1,2,3 - trihidroxibenzeno | pirogalol |
| C 6 H 4 (OH) 2 | 1,3 - dihidroxibenzeno | Resorcinol |
| C 6 H 4 (OH) 2 | 1,2-dihidroxibenzeno | Pirocatequina |
| C 6 H 4 (OH) 2 | 1,4 - dihidroxibenzeno | hidroquinona |
| C 6 H 2 OH (NO 2) 3 | 2,4,6-trinitrofenol | Ácido Pícrico |
| C 3 H 5 (OH) 3 | Propantriol -1,2,3 | Glicerol |
| C 2 H 4 (OH) 2 | Etanodiol - 1,2 | etilenoglicol |
| C6H5CH2OH | Fenilmetanol | Álcool benzílico |
| C 6 H 8 (OH) 6 | Hexanohexaol-1,2,3,4,5,6 | Sorbitol |
| C3H6O | Prapanon | Acetona |
| CH3OH | Metanol (álcool metílico) | álcool de madeira |
| CH2O | Metanal | Formaldeído |
| C2H4O | Etanal | aldeído acético, acetaldeído |
| C3H6O | Propanal | propionaldeído |
| C3H4O | Propenal | Acroleína |
| C 6 H 5 FILHO | Benzaldeído | aldeído benzóico |
| C4H8O | Butanal | Butialdeído |
| C5H10O | Pentanal | aldeído valérico |
| UNSD | Ácido metanóico | Ácido fórmico (sal - formato) |
| CH 3 COOH | Ácido etanoico | Ácido acético (sal - acetato) |
| C 2 H 5 COOH | ácido propanoico | ácido propiónico |
| C3H7COOH | Ácido butanóico | ácido butírico |
| C 4 H 9 COOH | Ácido pentanóico | Ácido valérico |
| C 5 H 11 COOH | Ácido hexanoico | Ácido capróico |
| C 6 H 13 COOH | Ácido heptanóico | Ácido enântico |
| C 7 H 15 COOH | Ácido octanóico | Ácido caprílico |
| C 8 H 17 COOH | Ácido não anóico | Ácido Pelargolico |
| NOOS - UNSD | Ácido etanodioico | Ácido oxálico (sal - oxalato) |
| HOOS -CH 2 - COOH | ácido propanodioico | Ácido malônico |
| HOOS - (CH 2) 2 - COOH | ácido butanodióico | ácido succínico |
| C 17 H 33 COOH (não preparado) | Ácido octadeenóico | Ácido oleico |
| C 15 H 31 COOH (anterior) | Ácido hexadecânico | Ácido palmítico |
| C 17 H 35 COOH (anterior) | Ácido octadecânico | Ácido esteárico (sal - estearato) |
Com o desenvolvimento da ciência química e o advento da um grande número novo compostos químicos a necessidade do desenvolvimento e adoção de um sistema de seus nomes compreensível para cientistas de todo o mundo, ou seja, . A seguir, uma visão geral das principais nomenclaturas compostos orgânicos.
Nomenclatura trivial
Nas origens do desenvolvimento da química orgânica, novos compostos foram atribuídos trivial nomes, ou seja nomes que se desenvolveram historicamente e muitas vezes estão associados à forma como foram obtidos, aparência e até gosto, etc. Tal nomenclatura de compostos orgânicos é chamada trivial. A tabela abaixo mostra alguns dos compostos que mantiveram seus nomes até hoje.

 Nomenclatura racional
Nomenclatura racional
Com a ampliação da lista de compostos orgânicos, tornou-se necessário associar seu nome à Base de Nomenclatura Racional de Compostos Orgânicos que é o nome do composto orgânico mais simples. Por exemplo:

No entanto, compostos orgânicos mais complexos não podem receber nomes dessa maneira. Neste caso, os compostos devem ser nomeados de acordo com as regras de nomenclatura sistemática da IUPAC.
Nomenclatura sistemática IUPAC
IUPAC (IUPAC) - união internacional química teórica e aplicada (União Internacional de Química Pura e Aplicada).
Nesse caso, ao nomear compostos, deve-se levar em consideração a localização dos átomos de carbono na molécula e os elementos estruturais. A mais utilizada é a nomenclatura substitucional de compostos orgânicos, ou seja, distingue-se a base básica da molécula, na qual os átomos de hidrogênio são substituídos por algumas unidades estruturais ou átomos.
Antes de começar a construir os nomes dos compostos, aconselhamos que você aprenda os nomes prefixos numéricos, raízes e sufixos usado em Nomenclatura IUPAC.

Assim como os nomes dos grupos funcionais: 
Os numerais são usados para indicar o número de ligações múltiplas e grupos funcionais:
Limitar radicais de hidrocarbonetos:

Radicais de hidrocarbonetos insaturados:

Radicais de hidrocarbonetos aromáticos:


Regras para construir o nome de um composto orgânico de acordo com a nomenclatura IUPAC:
- Selecione a cadeia principal da molécula
Determine todos os grupos funcionais presentes e sua precedência
Determine a presença de ligações múltiplas
- Numere a cadeia principal, e a numeração deve começar do final da cadeia mais próxima ao grupo sênior. Se houver várias dessas possibilidades, a cadeia é numerada de modo que a ligação múltipla ou outro substituinte presente na molécula receba o número mínimo.
Carbocíclico os compostos são numerados a partir do átomo de carbono associado ao grupo característico mais alto. Se houver dois ou mais substituintes, eles tentam numerar a cadeia de modo que os substituintes tenham os números mínimos.
- Crie um nome de conexão:
- Determinar a base do nome do composto que compõe a raiz da palavra, que denota um hidrocarboneto saturado com o mesmo número de átomos da cadeia principal.
- Após o radical do nome, segue um sufixo, indicando o grau de saturação e o número de ligações múltiplas. Por exemplo, - tetraeno, dieno. Na ausência de ligações múltiplas, use o sufixo - sk.
- Então, também o nome do grupo funcional sênior.
— Seguido por uma lista de substituintes em ordem alfabética indicando sua localização em algarismos arábicos. Por exemplo, - 5-isobutil, - 3-flúor. Na presença de vários substituintes idênticos, seu número e posição são indicados, por exemplo, 2,5 - dibromo-, 1,4,8-trimetil-.
Deve-se notar que os números são separados das palavras por um hífen e entre si por vírgulas.
Como exemplo Vamos nomear a seguinte conexão:
 1. Escolha circuito principal, que deve incluir grupo sênior- COOH.
1. Escolha circuito principal, que deve incluir grupo sênior- COOH.
Definir outros grupos funcionais: - OH, - Cl, - SH, - NH 2.
Vários títulos não.
2. Nós numeramos a cadeia principal começando com o grupo mais velho.
3. O número de átomos na cadeia principal é 12. Base do nome
éster 10-amino-6-hidroxi-7-cloro-9-sulfanil-metílico do ácido dodecanóico.
10-amino-6-hidroxi-7-cloro-9-sulfanil-metildodecanoato
Nomenclatura de isômeros ópticos
- Em algumas classes de compostos, como aldeídos, hidroxi e aminoácidos, o arranjo mútuo de substituintes é indicado por D, eu- nomenclatura. carta D denotar a configuração do isômero dextrógiro, eu- canhoto.
No centro D, L-a nomenclatura dos compostos orgânicos são projeções de Fischer:
- α-aminoácidos e α-hidroxiácidos isolar a "chave oxi-ácido", i.e. partes superiores de suas fórmulas de projeção. Se o grupo hidroxila (amino-) estiver localizado à direita, então este D-isômero, esquerdo eu-isômero.
Por exemplo, o ácido tartárico mostrado abaixo tem D- configuração por chave oxi-ácido: 
- para determinar as configurações de isômeros açúcares isolar a "chave de glicerina", i.e. compare as partes inferiores (átomo de carbono assimétrico inferior) da fórmula de projeção do açúcar com a parte inferior da fórmula de projeção do gliceraldeído.

A designação da configuração do açúcar e do sentido de rotação é semelhante à configuração do gliceraldeído, ou seja, D– a configuração corresponde à localização do grupo hidroxila está localizado à direita, eu configurações à esquerda.
Por exemplo, abaixo está a D-glicose.

2) R-, S-nomenclatura (nomenclatura Kahn, Ingold e Prelog)
Neste caso, os substituintes no átomo de carbono assimétrico estão dispostos em ordem de precedência. Os isômeros ópticos são designados R e S, e o racemato RS.
Para descrever a configuração da conexão de acordo com R,S-nomenclatura proceda da seguinte forma:
- Todos os substituintes no átomo de carbono assimétrico são determinados.
- A antiguidade dos deputados é determinada, ou seja, comparar suas massas atômicas. As regras para determinar a série de antiguidade são as mesmas da nomenclatura E/Z de isômeros geométricos.
- Os substituintes são orientados no espaço de modo que o substituinte júnior (geralmente hidrogênio) esteja no canto mais distante do observador.
- A configuração é determinada pela localização dos substituintes restantes. Se o movimento do sênior para o meio e depois para o deputado júnior (ou seja, em ordem decrescente de antiguidade) for realizado no sentido horário, essa é a configuração R, no sentido anti-horário - a configuração S.

A tabela abaixo lista os deputados em ordem crescente de precedência:

A base do nome do composto é a raiz da palavra, denotando um hidrocarboneto saturado com o mesmo número de átomos que a cadeia principal (por exemplo, met-, et-. pro p-, but-, pent-, hex -, etc). Isto é seguido por um sufixo que caracteriza o grau de saturação, -an, se não houver ligações múltiplas na molécula, -ene na presença de ligações duplas e -ni para ligações triplas, por exemplo, pentano, penteno. Se houver várias ligações múltiplas na molécula, o número de tais ligações é indicado no sufixo, por exemplo: -dieno, -trieno, e após o sufixo, a posição da ligação múltipla deve ser indicada em algarismos arábicos (para exemplo, buteno-1, buteno-2, butadieno-1,3):
CH 3 -CH 2 -CH \u003d CH 2 CH 3 -CH \u003d CH-CH 3 CH 2 \u003d CH-CH \u003d CH 2
buteno-1 buteno-2 butadieno-1,3
Além disso, o nome do grupo característico mais antigo da molécula é colocado no sufixo, indicando sua posição com um número. Outros substituintes são designados por prefixos. No entanto, eles não estão listados em ordem de antiguidade, mas em ordem alfabética. A posição do substituinte é indicada por um número antes do prefixo, por exemplo: 3-metil; 2-cloro e semelhantes. Se houver vários substituintes idênticos na molécula, seu número será indicado na frente do nome do grupo correspondente (por exemplo, dimetil-, tricloro-, etc.). Todos os números nos nomes das moléculas são separados das palavras por um hífen e uns dos outros por vírgulas. Os radicais de hidrocarbonetos têm seus próprios nomes.
Limitar radicais de hidrocarbonetos:
metil etil propil isopropil
Butil sec-butil
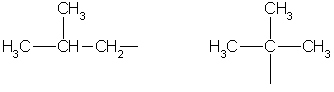
isobutil terc-butil
Radicais de hidrocarbonetos insaturados:
CH 2 \u003d CH- HC - C- CH 2 \u003d CH-CH 2 -
vinil etinil alilo
Radicais de hidrocarbonetos aromáticos:

fenil benzeno
Vamos usar a seguinte conexão como exemplo:

A escolha da cadeia é inequívoca, portanto, a raiz da palavra é pent, seguida do sufixo -en, indicando a presença de uma ligação múltipla; a ordem de numeração dá ao grupo mais alto (-OH) o número mais baixo; o nome completo do composto termina com um sufixo denotando grupo sênior(neste caso, o sufixo –o l indica a presença de um grupo hidroxila); a posição da ligação dupla e do grupo hidroxila é indicada por números.
Portanto, o composto dado é chamado penten-4-ol-2.
A nomenclatura trivial é uma coleção de nomes não sistemáticos historicamente estabelecidos de compostos orgânicos (por exemplo: acetona, ácido acético, formaldeído, etc). Os nomes triviais mais importantes são introduzidos no texto ao considerar as classes de compostos correspondentes.
A nomenclatura racional permite construir o nome de uma substância com base em sua estrutura com um composto mais simples escolhido como protótipo. A maneira de tal construção é ilustrada pelos seguintes exemplos:
ácido trimetilmetano acetilacetona fenilacético
No passado, os cientistas dividiram todas as substâncias na natureza em condicionalmente inanimadas e vivas, incluindo os reinos animal e vegetal entre os últimos. As substâncias do primeiro grupo são chamadas de minerais. E os que entraram no segundo, passaram a ser chamados de substâncias orgânicas.
O que se quer dizer com isso? A classe de substâncias orgânicas é a mais extensa entre todos os compostos químicos conhecidos pelos cientistas modernos. A questão de quais substâncias são orgânicas pode ser respondida da seguinte forma - são compostos químicos que incluem carbono.
Observe que nem todos os compostos contendo carbono são orgânicos. Por exemplo, corbides e carbonatos, ácido carbônico e cianetos, óxidos de carbono não estão entre eles.
Por que existem tantas substâncias orgânicas?
A resposta a esta pergunta está nas propriedades do carbono. Este elemento é curioso por ser capaz de formar cadeias a partir de seus átomos. E, ao mesmo tempo, a ligação de carbono é muito estável.
Além disso, em compostos orgânicos, exibe uma alta valência (IV), ou seja, capacidade de formar ligações químicas com outras substâncias. E não apenas simples, mas também duplos e até triplos (caso contrário - múltiplos). À medida que a multiplicidade de ligações aumenta, a cadeia de átomos torna-se mais curta e a estabilidade da ligação aumenta.
E o carbono é dotado da capacidade de formar estruturas lineares, planas e tridimensionais.
É por isso que as substâncias orgânicas na natureza são tão diversas. Você mesmo pode verificar facilmente: fique na frente de um espelho e observe cuidadosamente seu reflexo. Cada um de nós é um guia de caminhada para química orgânica. Pense nisso: pelo menos 30% da massa de cada uma de suas células são compostos orgânicos. As proteínas que construíram seu corpo. Carboidratos, que servem como "combustível" e fonte de energia. Gorduras que armazenam reservas de energia. Hormônios que controlam a função dos órgãos e até mesmo o seu comportamento. Enzimas que começam reações químicas dentro de você. E até mesmo " fonte”, As fitas de DNA são todos compostos orgânicos à base de carbono.
Composição de substâncias orgânicas
Como dissemos no início, o principal material de construção da matéria orgânica é o carbono. E praticamente todos os elementos, combinados com carbono, podem formar compostos orgânicos.
Na natureza, na maioria das vezes na composição de substâncias orgânicas são hidrogênio, oxigênio, nitrogênio, enxofre e fósforo.
A estrutura das substâncias orgânicas
A diversidade de substâncias orgânicas no planeta e a diversidade de sua estrutura podem ser explicadas características característicasátomos de carbono.
Você se lembra que os átomos de carbono são capazes de formar ligações muito fortes uns com os outros, conectando-se em cadeias. O resultado são moléculas estáveis. A maneira pela qual os átomos de carbono se encadeiam (organizam-se em ziguezague) é uma das características principais seus prédios. O carbono pode se combinar tanto em cadeias abertas quanto em cadeias fechadas (cíclicas).
Também é importante que a estrutura substancias químicas os afeta diretamente Propriedades quimicas. papel importante também interpreta como átomos e grupos de átomos em uma molécula afetam uns aos outros.
Devido às peculiaridades da estrutura, o número de compostos de carbono do mesmo tipo vai para dezenas e centenas. Por exemplo, podemos considerar compostos de hidrogênio de carbono: metano, etano, propano, butano, etc.
Por exemplo, metano - CH 4. Essa combinação de hidrogênio e carbono condições normais reside em um gasoso estado de agregação. Quando o oxigênio aparece na composição, um líquido é formado - álcool metílico CH 3 OH.
Não apenas substâncias com composição qualitativa diferente (como no exemplo acima) exibem propriedades diferentes, mas substâncias da mesma composição qualitativa também são capazes disso. Um exemplo seria habilidade diferente metano CH 4 e etileno C 2 H 4 reagem com bromo e cloro. O metano é capaz de tais reações somente quando aquecido ou sob luz ultravioleta. E o etileno reage mesmo sem iluminação e aquecimento.
Considere esta opção: a composição qualitativa dos compostos químicos é a mesma, a quantitativa é diferente. Então as propriedades químicas dos compostos são diferentes. Como no caso do acetileno C 2 H 2 e benzeno C 6 H 6.
Nem o último papel nesta variedade é desempenhado por tais propriedades de substâncias orgânicas, "ligadas" à sua estrutura, como isomerismo e homologia.
Imagine que você tem duas substâncias aparentemente idênticas - a mesma composição e a mesma fórmula molecular para descrevê-las. Mas a estrutura dessas substâncias é fundamentalmente diferente, do que se segue a diferença em química e propriedades físicas. Por exemplo, a fórmula molecular C 4 H 10 pode ser escrita duas várias substâncias: butano e isobutano.

Nós estamos falando sobre isômeros- compostos que têm a mesma composição e peso molecular. Mas os átomos em suas moléculas estão dispostos em ordem diferente(estrutura ramificada e não ramificada).
Relativo homologia- esta é uma característica de tal cadeia de carbono em que cada membro seguinte pode ser obtido adicionando um grupo CH 2 ao anterior. Cada série homóloga pode ser expressa por um Fórmula geral. E conhecendo a fórmula, é fácil determinar a composição de qualquer um dos membros da série. Por exemplo, homólogos de metano são descritos pela fórmula C n H 2n+2 .
À medida que a “diferença homóloga” CH 2 é adicionada, a ligação entre os átomos da substância é reforçada. Vamos pegar a série homóloga do metano: seus primeiros quatro membros são gases (metano, etano, propano, butano), os próximos seis são líquidos (pentano, hexano, heptano, octano, nonano, decano) e depois substâncias no estado sólido de agregação seguem (pentadecano, eicosan, etc.). E quanto mais forte a ligação entre os átomos de carbono, maior o peso molecular, pontos de ebulição e fusão das substâncias.
Que classes de substâncias orgânicas existem?
à matéria orgânica origem biológica relacionar:
- proteínas;
- carboidratos;
- ácidos nucleicos;
- lipídios.
Os três primeiros pontos também podem ser chamados de polímeros biológicos.
Uma classificação mais detalhada de produtos químicos orgânicos abrange substâncias não apenas de origem biológica.
Os hidrocarbonetos são:
- compostos acíclicos:
- hidrocarbonetos saturados (alcanos);
- hidrocarbonetos insaturados:
- alcenos;
- alcinos;
- alcadienos.
- compostos cíclicos:
- compostos carbocíclicos:
- alicíclico;
- aromático.
- compostos heterocíclicos.
- compostos carbocíclicos:
Existem também outras classes de compostos orgânicos em que o carbono se combina com outras substâncias além do hidrogênio:
- álcoois e fenóis;
- aldeídos e cetonas;
- ácidos carboxílicos;
- ésteres;
- lipídios;
- carboidratos:
- monossacarídeos;
- oligossacarídeos;
- polissacarídeos.
- mucopolissacarídeos.
- aminas;
- aminoácidos;
- proteínas;
- ácidos nucleicos.
Fórmulas de substâncias orgânicas por classes

Exemplos de substâncias orgânicas
Como você se lembra, em corpo humano vários tipos de substâncias orgânicas são a base das fundações. Estes são nossos tecidos e fluidos, hormônios e pigmentos, enzimas e ATP, e muito mais.
Nos corpos de humanos e animais, as proteínas e gorduras são priorizadas (metade do peso seco de uma célula animal é proteína). Nas plantas (cerca de 80% da massa seca da célula) - para carboidratos, principalmente complexos - polissacarídeos. Inclusive para celulose (sem a qual não haveria papel), amido.
Vamos falar sobre alguns deles com mais detalhes.
Por exemplo, sobre carboidratos. Se fosse possível tirar e medir as massas de todas as substâncias orgânicas do planeta, seriam os carboidratos que venceriam essa competição.
Eles servem como uma fonte de energia no corpo, são materiais de construção para células, bem como realizar o fornecimento de substâncias. As plantas usam amido para esse fim e glicogênio para animais.
Além disso, os carboidratos são muito diversos. Por exemplo, carboidratos simples. Os monossacarídeos mais comuns na natureza são as pentoses (incluindo a desoxirribose, que faz parte do DNA) e as hexoses (glicose, que você conhece bem).
Como tijolos, em um grande canteiro de obras da natureza, os polissacarídeos são construídos a partir de milhares e milhares de monossacarídeos. Sem eles, mais precisamente, sem celulose, sem amido, não haveria plantas. Sim, e animais sem glicogênio, lactose e quitina teriam dificuldades.
Vamos olhar com atenção esquilos. A natureza é a maior mestra dos mosaicos e quebra-cabeças: de apenas 20 aminoácidos, 5 milhões de tipos de proteínas são formados no corpo humano. As proteínas também têm muitas funções vitais. Por exemplo, construção, regulação de processos no corpo, coagulação do sangue (existem proteínas separadas para isso), movimento, transporte de certas substâncias no corpo, também são uma fonte de energia, na forma de enzimas atuam como um catalisador para reações, fornecem proteção. Ao proteger o corpo de influências externas negativas papel importante jogar anticorpos. E se ocorrer uma discórdia no ajuste fino do corpo, os anticorpos, em vez de destruir inimigos externos, podem atuar como agressores de seus próprios órgãos e tecidos do corpo.

As proteínas também são divididas em simples (proteínas) e complexas (proteínas). E eles têm propriedades inerentes apenas a eles: desnaturação (a destruição que você notou mais de uma vez quando ferveu um ovo cozido) e renaturação (esta propriedade encontrou ampla aplicação na fabricação de antibióticos, concentrados alimentares, etc.).
Não vamos ignorar e lipídios(gorduras). Em nosso corpo, eles servem como fonte de reserva de energia. Como solventes, eles ajudam no curso das reações bioquímicas. Participe da construção do corpo - por exemplo, na formação das membranas celulares.
E mais algumas palavras sobre compostos orgânicos tão curiosos como hormônios. Eles estão envolvidos em reações bioquímicas e metabolismo. Esses pequenos hormônios fazem homens homens (testosterona) e mulheres mulheres (estrogênio). Eles nos deixam felizes ou tristes (os hormônios da tireóide desempenham um papel importante nas mudanças de humor e as endorfinas dão uma sensação de felicidade). E até determinam se somos “corujas” ou “cotovias”. Você está pronto para estudar até tarde ou prefere acordar cedo e fazer trabalho de casa antes da escola, decide não só sua rotina diária, mas também alguns hormônios adrenais.
Conclusão
O mundo da matéria orgânica é realmente incrível. Basta mergulhar um pouco em seu estudo para tirar o fôlego do sentimento de parentesco com toda a vida na Terra. Duas pernas, quatro ou raízes em vez de pernas - estamos todos unidos por magia laboratório químico mãe natureza. Isso faz com que os átomos de carbono se unam em cadeias, reajam e criem milhares de compostos químicos tão diversos.
Agora você tem um pequeno guia de química orgânica. Obviamente, nem todas as informações possíveis são apresentadas aqui. Alguns pontos você pode ter que esclarecer por conta própria. Mas você sempre pode usar a rota que planejamos para sua pesquisa independente.
Você também pode usar a definição de matéria orgânica dada no artigo, a classificação e fórmulas gerais de compostos orgânicos e informações gerais sobre eles para se preparar para as aulas de química na escola.
Conte-nos nos comentários qual seção de química (orgânica ou inorgânica) você mais gosta e por quê. Não se esqueça de compartilhar o artigo nas redes sociais para que seus colegas também possam usá-lo.
Por favor, informe se você encontrar alguma imprecisão ou erro no artigo. Somos todos humanos e todos cometemos erros às vezes.
site, com cópia total ou parcial do material, é necessário um link para a fonte.
Existem muitos compostos orgânicos, mas entre eles existem compostos com propriedades comuns e semelhantes. Portanto, são todos características comuns classificados, combinados em classes e grupos separados. A classificação é baseada em hidrocarbonetos – compostos formados apenas por átomos de carbono e hidrogênio. O restante da matéria orgânica é "Outras classes de compostos orgânicos".
Os hidrocarbonetos são divididos em duas grandes classes: compostos acíclicos e cíclicos.
Compostos acíclicos (gordurosos ou alifáticos) – compostos cujas moléculas contêm uma cadeia de carbono aberta (não fechada em um anel) não ramificada ou ramificada com ligações simples ou múltiplas. Os compostos acíclicos são divididos em dois grupos principais:
hidrocarbonetos saturados (limitantes) (alcanos), em que todos os átomos de carbono estão interligados apenas por ligações simples;
hidrocarbonetos insaturados (insaturados), em que entre os átomos de carbono, exceto para conexões simples Existem também ligações duplas e triplas.
Os hidrocarbonetos insaturados (insaturados) são divididos em três grupos: alcenos, alcinos e alcadienos.
Alcenos(olefinas, hidrocarbonetos de etileno) – hidrocarbonetos insaturados acíclicos que contêm uma ligação dupla entre átomos de carbono formam uma série homóloga com a fórmula geral C n H 2n . Os nomes dos alcenos são formados a partir dos nomes dos alcanos correspondentes com o sufixo "-an" substituído pelo sufixo "-en". Por exemplo, propeno, buteno, isobutileno ou metilpropeno.
Alcinos(hidrocarbonetos de acetileno) – hidrocarbonetos que contêm uma ligação tripla entre átomos de carbono formam uma série homóloga com a fórmula geral C n H 2n-2 . Os nomes dos alcenos são formados a partir dos nomes dos alcanos correspondentes com o sufixo "-an" substituído pelo sufixo "-in". Por exemplo, etina (acileno), butina, peptina.
Alcadienos – compostos orgânicos que contêm duas ligações duplas carbono-carbono. Dependendo de como as ligações duplas são organizadas uma em relação à outra, os dienos são divididos em três grupos: dienos conjugados, alenos e dienos com ligações duplas isoladas. Tipicamente, os dienos incluem 1,3-dienos acíclicos e cíclicos, formando com as fórmulas gerais C n H 2n-2 e C n H 2n-4 . Os dienos acíclicos são isômeros estruturais de alcinos.
Os compostos cíclicos, por sua vez, são divididos em dois grandes grupos:
- compostos carbocíclicos – compostos cujos anéis consistem apenas em átomos de carbono; Os compostos carbocíclicos são divididos em alicíclicos. – saturadas (cicloparafinas) e aromáticas;
- compostos heterocíclicos – compostos cujos ciclos consistem não apenas de átomos de carbono, mas de átomos de outros elementos: nitrogênio, oxigênio, enxofre, etc.
Em moléculas de compostos acíclicos e cíclicosátomos de hidrogênio podem ser substituídos por outros átomos ou grupos de átomos, assim, pela introdução de grupos funcionais, podem ser obtidos derivados de hidrocarbonetos. Essa propriedade amplia ainda mais as possibilidades de obtenção de diversos compostos orgânicos e explica sua diversidade.
A presença de certos grupos nas moléculas de compostos orgânicos determina a generalidade de suas propriedades. Esta é a base para a classificação dos derivados de hidrocarbonetos.
 "Outras classes de compostos orgânicos" incluem o seguinte:
"Outras classes de compostos orgânicos" incluem o seguinte:
Álcoois são obtidos pela substituição de um ou mais átomos de hidrogênio por grupos hidroxila – Oh. É um composto com a fórmula geral R – (OH) x, onde x – número de grupos hidroxila.
Aldeídos contêm um grupo aldeído (C = O), que está sempre no final da cadeia de hidrocarbonetos.
ácidos carboxílicos contêm um ou mais grupos carboxila – COOH.
Ésteres – derivados de ácidos contendo oxigênio, que são formalmente os produtos da substituição de átomos de hidrogênio de hidróxidos – função OH ácido por resíduo de hidrocarboneto; também são considerados como derivados acil de álcoois.
Gorduras (triglicerídeos) – compostos orgânicos naturais, ésteres completos de glicerol e ácidos graxos monocomponentes; pertencem à classe dos lipídios. As gorduras naturais contêm em sua composição três radicais ácidos de estrutura não ramificada e, geralmente, numero parátomos de carbono.
Carboidratos – substâncias orgânicas contendo uma cadeia linear de vários átomos de carbono, um grupo carboxila e vários grupos hidroxila.
Aminas contém um grupo amino – NH2
Aminoácidos– compostos orgânicos, cuja molécula contém simultaneamente grupos carboxila e amina.
Esquilos – substâncias orgânicas de alto peso molecular, que consistem em alfa-aminoácidos ligados em uma cadeia por uma ligação peptídica.
Ácidos nucleicos – compostos orgânicos de alto peso molecular, biopolímeros formados por resíduos de nucleotídeos.
Você tem alguma pergunta? Quer saber mais sobre a classificação dos compostos orgânicos?
Para obter a ajuda de um tutor - registre-se.
A primeira aula é grátis!
site, com cópia total ou parcial do material, é necessário um link para a fonte.
